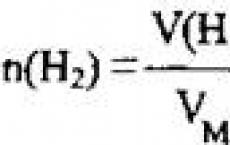Розрахунки, пов'язані з перебігом хімічних реакцій. Розрахунки за хімічними рівняннями Розрахунки за рівняннями хімічних реакцій завдання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
Приклади вирішення типових завдань
ІІ.Розрахунки за рівняннями хімічних реакцій
Завдання 7. Який обсяг водню (н.у.) витратить на відновлення 0,4 моль хром(ІІІ) оксиду?
Дано:
Рішення
Запишемо рівняння реакції:
1. З написаного рівняння видно, що
2. Для знаходження об'єму водню скористаємося формулою
Відповідь: V (H 2) = 26,88 л.
Завдання 8. Яка маса алюмінію вступила в реакцію із хлоридною кислотою, якщо виділилося 2688 мл (н.у.) водню?
Дано:
![]()
Рішення
Запишемо рівняння реакції:

Складемо пропорцію: 54 г алюмінію відповідає 67,2 л водню, а х г алюмінію - 2, 688 л водню:

Відповідь: m (А l ) = 2,16 р.
Завдання 9. Який обсяг кисню необхідно використати, щоб спалити 120 м 3 суміші азоту та карбон(II) оксиду, якщо об'ємна частка азоту у суміші становить 40 %?
Дано:

Рішення
1. У вихідній суміші горить тільки карбон(II) оксид, об'ємна частка якого:
2. За формулою ![]() обчислимо об'єм карбон(II) оксиду в суміші:
обчислимо об'єм карбон(II) оксиду в суміші:
3. Запишемо рівняння реакції та, використовуючи закон об'ємних відносин, проведемо розрахунок:

Відповідь: V(O 2 ) = 3 6 м 3 .
Завдання 10. Обчисліть об'єм газової суміші, яка утворюється внаслідок термічного розкладання 75,2 г купруму (ІІ) нітрату.
Дано:
![]()
Рішення
Запишемо рівняння реакції:

1. Розрахуємо кількість речовини купрум(ІІ) нітрату. M (Cu (NO 3 ) 2) = 188 г/моль:
2. Проводимо розрахунок кількості речовин газів, що утворюються за рівняннями реакції:
3. Обчислимо обсяг газової суміші. V M = 22,4 л/моль:
Відповідь: V (суміші) = 22,4 л.
Завдання 11. Який об'єм сульфур(І V ) оксиду можна отримати при випаленні 2,425 т цинкової обманки, масова частка цинку сульфіду в якій становить 80%?
Дано:

Рішення
1. Розрахуємо масу ZnS в цинковій обманці:

2. Складемо рівняння реакції, за яким і обчислимо об'єм SO 2 . M (ZnS ) = 97 г/моль, V M = 22,4 л/моль:

Відповідь: V (SO 2) = 448 м 3 .
Завдання 12. Обчисліть об'єм кисню, який можна отримати при повному термічному розкладанні 34 г розчину дигідрогену перекису з масовою часткою Н 2 O 2 30%.
Дано:

Рішення
1. Розрахуємо масу дигідрогену пероксиду в розчині. М(Н 2 O 2 ) = 34 г/моль:

2. Складемо рівняння реакції та проведемо по них розрахунок. V M = 22,4 л/моль:

Відповідь: V(O 2 ) = 3,36 л.
Завдання 13. Яку масу технічного алюмінію з масовою часткою домішок 3 % необхідно використовувати для добування 2,5 моль заліза із залізної окалини?
Дано:

Рішення
1. Запишемо рівняння реакції та розрахуємо масу чистого алюмінію, яку необхідно використовувати на реакцію:

2. Оскільки алюміній містить 3% домішок, то
3. З формули  розрахуємо масу технічного алюмінію (тобто з домішками):
розрахуємо масу технічного алюмінію (тобто з домішками):
![]()
Відповідь: m (А l) Тех. = 61,9 р.
Завдання 14. Внаслідок нагрівання 107,2 г суміші калій сульфату та калій нітрату виділилося 0,1 моль газу. Обчисліть масу калій сульфату вихідної суміші солей.
Дано:

Рішення
1. Калій сульфат – речовина термічно стійка. Отже, при нагріванні розкладається лише нітрат калій. Запишемо реакцію, кладемо пропорцію, визначимо кількість речовини калію нітрату, що розклалася:

2. Обчислимо масу 0,2 моль калію нітрату. M (KNO 3 ) = 101 г/моль:
3. Обчислимо масу калій сульфату у вихідній суміші:
Відповідь: m(K 2 SO 4) = 87 р.
Завдання 15. При повному термічному розкладі 0,8 моль алюмінію нітрату одержали 35,7 г твердого залишку. Обчисліть відносний вихід речовини (%), що міститься у твердому залишку.
Дано:

Рішення
1. Запишемо рівняння реакції розкладання алюмінію нітрату. Складемо пропорцію, визначимо кількість речовини n (А l 2 O 3 ):

2. Розрахуємо масу оксиду, що утворився. М(А l 2 O 3 ) = 102 г/моль:

3. Розрахуємо відносний вихід А l 2 O 3 за формулою:
Відповідь: η (А l 2 O 3) = 87,5%.
Завдання 16. До розкладання нагріли 0,4 моль ферум(III) гідроксиду. Отриманий оксид відновили воднем та отримали 19,04 г заліза. Обчисліть відносний вихід заліза (%).
Дано:

Рішення
1. Запишемо рівняння реакцій:

2. За рівняннями складаємо стехіометричну схему та за пропорцією визначимо теоретичний вихід заліза n (Fe) т атаки. :

3. Обчислимо масу заліза, яку теоретично можна було б одержати, виходячи з проведених реакцій(M (Fe) = 56 г/моль):
4. Розрахуємо відносний вихід заліза:

Відповідь: η (Fe) = 85%.
Завдання 17. При розчиненні у воді 234 г калію отримали 56 л газу (н.у.). Обчисліть відносний вихід газу (%).
Дано:

Рішення
1. Запишемо рівняння реакції та обчислимо обсяг водню, який теоретично, тобто. відповідно до рівняння реакції, можна отримати з даної маси калію:

Складемо пропорцію:

2. Обчислимо відносний вихід водню:

Відповідь: η (Н 2) = 83,3%.
Задача 18. При спалюванні 0,0168 м 3 ацетилену отримали 55 г карбон(І V ) оксиду. Обчисліть відносний вихід вуглекислого газу (%).
Дано:

Рішення
1. Запишемо рівняння реакції горіння ацетилену, складемо пропорцію та обчислимо масу карбон(І V ) оксиду, яку можна одержати теоретично. V M = 22,4 л/моль, М(СО 2) = 44 г/моль:

2. Обчислимо відносний вихід карбон(І V) оксиду:

Відповідь: η(CO 2 ) = 83,3%.
Завдання 19. В результаті каталітичного окислення 5,8 моль аміаку отримали 0,112 м 3 оксиду нітроген(II). Обчисліть відносний вихід одержаного оксиду (%).
Дано:

Рішення
1. Запишемо рівняння реакції каталітичного окислення аміаку, складемо пропорцію і обчислимо об'єм нітроген(І V ) оксиду, який теоретично можна отримати ( V M = 22,4 л/моль):

2. Розрахуємо відносний вихід нітроген(II) оксиду:

Відповідь: η(NO) = 86,2%.
Завдання 20. Крізь надлишок розчину гідроксиду калій пропустили 1,2 моль азот(І V ) оксиду. Отримали 0,55 моль калію нітрату. Обчисліть відносний вихід одержаної солі (%).
Дано:

Рішення
1. Запишемо рівняння хімічної реакції, складемо пропорцію та обчислимо масу калій нітрату, яку теоретично можна отримати:

2. Обчислимо відносний вихід калій нітрату:
Відповідь: η (KNO 3) = 91,7%.
Завдання 2 1 . Яку масу сульфату амоній можна видобути з 56 л аміаку, якщо відносний вихід солі становить 90 %.
Дано:

Рішення
1. Запишемо рівняння реакції та складемо пропорцію та обчислимо масу солі, яку теоретично можна отримати з 56 л NH 3 . V M = 22,4 л/моль M((NH 4) 2 S Про 4 ) = 132 г/моль:

2. Обчислимо масу солі, яку можна отримати практично:
Відповідь: m ((NH 4 ) 2 S О 4 ) = 148,5 г.
Завдання 22. Хлором повністю окислили 1,4 моль заліза. Яку масу солі одержали, якщо її вихід становить 95 %?
Дано:

Рішення
1. Запишемо рівняння реакції та проведемо розрахунок маси солі, яку можна отримати теоретично. M (FeCl 3 ) = 162,5 г/моль:

2. Розрахуємо масу FeCl 3 , яку отримали практично:
Відповідь: m (FeCl 3) прак. ≈ 216 р.
Завдання 23. До розчину, що містить 0,15 моль калій ортофосфату, долили розчин, у якому містилося 0,6 моль аргентум(І) нітрату. Визначте масу осаду, що утворився.
Дано:

Рішення
1. Запишемо рівняння реакції ( M (Ag 3 P O 4) = 419 г/моль):

З нього видно, що для реакції з 0,15 моль До 3 РО 4 потрібно 0,45 моль (0,15 · 3 = 0,45) аргентум(І) нітрату. Оскільки, згідно з умовою завдання, кількість речовини AgN У 3 становить 0,6 моль, саме цю сіль узято надлишку, тобто її частина залишається не використаною. Калій ортофосфат вступить у реакцію повністю, а тому вихід продуктів розраховуємо за його кількістю.
2. Складаємо пропорцію:

Відповідь: m (Ag 3 P O 4 ). = 62,85 р.
Завдання 24. У розчин, у якому містилося 58,4 г хлороводню, помістили 16,2 г алюмінію. Який обсяг газу (н.у.) виділився?
Дано:

Рішення
1. Обчислимо кількість речовини алюмінію та хлороводню. М(А l ) = 27 г/моль, М(НС l ) = 36,5 г/моль:

2. Запишемо рівняння реакції та встановимо речовину, яка взята у надлишку:

Розрахуємо кількість речовини алюмінію, яку можна розчинити у цій кількості соляної кислоти:

Отже, алюміній взятий у надлишку: кількість його речовини (0,6 моль) більша за необхідну. Об'єм водню розраховуємо за кількістю речовини хлороводню.
3. Обчислимо обсяг водню, що виділився. V M = 22,4 л/моль:

Відповідь: V (H 2) = 17,92 л.
Задача 25. Суміш, що містила 0,4 л ацетилену та 1200 мл кисню, призвели до умов реакції. Який об'ємкарбон(І V ) оксиду утворився?
Дано:

Рішення
Запишемо рівняння реакції:

Відповідно до закону об'ємних співвідношень, з наведеного рівняння випливає, що на кожні 2 обсяги З 2 Н 2 витрачається 5 обсягів O 2 з утворенням 4 обсягів карбон(І V ) оксиду. А тому спочатку визначимо речовину, яка є надлишком - перевіримо, чи вистачить кисню на спалювання ацетилену:
Оскільки за умовами завдання спалювання ацетилену взято 1,2 л, а потрібно 1л, робимо висновок, що кисень взятий у надлишку, а об'єм карбон(І V ) оксиду розраховуємо за обсягом ацетилену, скориставшись законом об'ємних співвідношень газів:
Відповідь: V(CO 2 ) = 0,8 л.
Задача 26. Суміш, що містить 80 мл сірководню та 120 мл O 2 , привели до умов реакції та отримали 70 мл сульфур(І V ) оксиду. Вимірювання обсягів газів проводили за однакових умов. Обчисліть відносний вихід сульфур(IV) оксиду (%).
Дано:

Рішення
1. Запишемо рівняння реакції горіння сірководню:

2. Перевіримо, чи вистачить кисню на спалювання 80 мл сірководню:
Отже, кисню вистачить, бо його взяли 120 мл у стехіометричній кількості. Надлишку однієїз речовин немає. А тому обсяг SO 2 можна розрахувати за будь-якою з них:
3. Обчислимо відносний вихід сульфур(І V) оксиду:
Відповідь: η (SO 2) = 87,5%.
Завдання 27. При розчиненні у воді 0,28 г лужного металу виділилося 0,448 л водню (н.у.). Назвіть металі вкажіть його протонне число.
Дано:

Рішення
1. Запишемо рівняння реакції(V M = 22,4 л/моль):

Складемо пропорцію та розрахуємо кількість речовини металу:

2. Обчислимо значення молярної маси металу, що вступив у реакцію:
![]()
Це Літій. Протонне число Літію - 3.
Відповідь: Z(Me) = 3.
Завдання 28. В результаті повного термічного розкладання 42,8 г гідроксиду тривалентного металевого елемента одержали 32 г твердого залишку. Вкажіть молярну масу металевого елемента.
Дано:

Рішення
1. Напишемо рівняння реакції у загальному вигляді:
Оскільки єдиною відомою речовиною цієї реакції є вода, розрахунки проводитимемо за масою води, що утворилася. Маючи закон збереження маси речовин, визначаємо його масу:
2. За рівнянням реакції проведемо розрахунок молярної маси гідроксиду металевого елемента. Молярнумасу гідроксиду Ме(ОН) 3 позначимо х г/моль (М(Н 2) O) = 18 г/моль):

3. Обчислимо значення молярної маси металевого елемента:
Це Ферум.
Відповідь: М(Ме) = 56 г/моль.
Завдання 29. Купрум(II) оксидом окислили 13,8 г насиченого одноатомного спирту та отримали 9,9 г альдегіду, відносний вихід якого становить 75 %. Назвіть спирт та вкажіть його молярну масу.
Дано:

Рішення
Найоптимальніший варіант запису формули насиченого одноатомного спирту для написання рівняння реакції його окиснення - це R - CH 2 OH , де R - алкільний заступник, загальна формула якого n Н 2 n +1 . Це зумовлено тим, що саме група СН 2 ВІНзмінюється під час реакції окислення, тобто перетворюється на альдегідну групу-СНО.
1. Запишемо рівняння реакції окислення спирту до альдегіду у загальному вигляді:
2. Обчислимо теоретичну масу альдегіду:

Для подальшого вирішення цього завдання можна використовувати 2 способи.
І метод (математичний метод, який передбачає виконання певної кількості арифметичних операцій).
Позначимо молярну масу алькільного заступника M (R) через х г/моль. Тоді:
![]()
Складемо пропорцію і обчислимо молярну масу алкільного заступника:

Отже, алкільний заступник - метил-СН 3 а спирт - етанол СН 3 -СН 2 -ВІН; М(З 2 Н 5 ОН) = 46 г/моль.
ІІ метод.
Обчислимо різницю молярних мас органічних продуктів відповідно до рівняння:
Відповідно до умови Δ m р = 13,8 – 13,2 = 0,6 (г).
Складемо пропорцію: якщо реакцію вступає 1 моль RCH 2 OH , то різниця мас становить 2 г, а якщо в моль RCH 2 OH , то різниця мас – 0,6 г.

За формулою  розрахуємо молярну масу спирту:
розрахуємо молярну масу спирту:

Отже, результат той самий.
Відповідь: М(З 2 Н 5 ОН) = 46 г/моль.
Завдання 30 . При повному зневодненні 87,5 г кристалогідрату ферум(III) нітрату отримали 1,5 моль водяної пари. Встановіть формулу вихідної речовини.
Дано:

Рішення
1. Обчислимо масу 1,5 моль води, отриманої результаті реакції. М(Н 2 O) = 18 г/моль:
2. Виходячи із закону збереження маси, обчислимо масу солі, яку отримали при нагріванні кристалогідрату:
3. Розрахуємо кількість речовини Fe(NO 3) 3 . M (Fe (NO 3 ) 3 ) = 242 г/моль:
4. Обчислимо співвідношення кількостей речовини безводної солі та води:

На 0,25 моль солі припадає 1,5 моль води на 1 моль солі-х моль:
Відповідь: формула кристалогідрату - Fe (NO 3) 3 · 6Н2O.
Завдання 31. Обчисліть об'єм кисню, необхідний для спалювання 160 м 3 суміші карбон(II) оксиду, азоту та етану, якщо об'ємні частки компонентів суміші відповідно становлять 50,0, 12,5 та 37,5 %.
Дано:

Рішення
1. За формулою ![]() обчислимо обсяги горючих компонентів, а самекарбон(II) оксиду та етану (зауважимо, що азот не горить):
обчислимо обсяги горючих компонентів, а самекарбон(II) оксиду та етану (зауважимо, що азот не горить):
2. Напишемо рівняння реакцій горіння СО та С 2 Н 6:
![]()
3. Скористаємося законом об'ємних співвідношень газів та проведемо розрахунок обсягів кисню за кожнимз рівнянь реакцій:

4. Обчислимо сумарний обсяг кисню:
Відповідь: V (Про 2) = 250 м 3 .
Розрахунки з хімічних рівнянь
Рівняння хімічних реакцій мають велике практичне значення для розрахунків, пов'язаних із тією чи іншою реакцією.
Розрахунки кількостей речовин, що у хімічних реакціях, називаються стехиометрическими.
Стехіометрія - розділ хімії, що вивчає масові та об'ємні відносини між реагентами.
Подивимося, як можна за рівняннями визначити масу та кількість речовин, що беруть участь у реакції. Згадаймо, що ці величини пов'язані між собою рівнянням:
Крім того, у задачах із хімічних рівнянь часто використовується пропорція.
Розглянемо прикладом задачі за хімічним рівнянням: Обчислити масу оксиду заліза (II), який утворюється при окисненні киснем 11,2 г заліза.

Рішення. Складемо рівняння хімічної реакції. За умовою завдання залізо взаємодіє з киснем Fe+O2 з утворенням оксиду заліза (II) FeO. Розставимо коефіцієнти, отримаємо 2Fe+O2→2FeO. Вкажемо кількісні відносини, в яких у цій реакції беруть участь вихідні речовини та продукти, зазначені в задачі, кількість речовини за рівнянням заліза – 2 моль, оксиду заліза (II) – 2 моль. Знайдемо кількість речовини за умовою завдання. Кількість речовини заліза дорівнює відношенню маси заліза до його молярної маси. 11,2 г: 56 г/моль = 0,2 моль. Визначимо кількість речовини, що шукається в задачі. Якщо з 2 моль заліза виходить 2 моль оксиду заліза (II), то з 0,2 моль заліза виходить х моль оксиду заліза (II). х = 0,2 · 2: 2 = 0,2. Кількість речовини оксиду заліза (II) дорівнює 0,2 моль. Знайдемо масу оксиду заліза (ІІ). Маса оксиду заліза (II) дорівнює добутку кількості речовини оксиду заліза (II) на молярну масу оксиду заліза (II). 0,2 моль 72 г/моль = 14,4 г. Відповідь: маса оксиду заліза (II) дорівнює 14,4 г.
Таким чином, алгоритм розв'язання подібного завдання може бути зведений до наступного:
1.записати умову завдання;
2.скласти рівняння реакції;
3.заказать кількісні відносини, у яких у цій реакції беруть участь вихідні речовини і продукти;
4. визначити кількість кожної речовини за відомою з умови масою;
5. підписати отримані значення кількості речовин під рівнянням реакції;
6. визначити шукане в задачі кількість речовини;
7.найти масу необхідної речовини;
8.записати відповідь.
Вирішимо ще одне завдання.
Скільки грамів перекису водню необхідно розкласти, щоб отримати 8 г кисню. Дано: маса кисню 8 р.

Рішення. Складемо рівняння хімічної реакції. Перекис водню розкладається на воду та кисень. Н2О2→ Н2О + О2. Розставимо коефіцієнти. 2Н2О2 → 2Н2О + О2. Вкажемо кількісні відносини, в яких у цій реакції беруть участь вихідні речовини та продукти, зазначені в задачі, кількість речовини за рівнянням перекису водню – 2 моль, кисню – 1 моль. Знайдемо кількість речовини за умовою завдання. Кількість речовини кисню дорівнює відношенню його до молярної маси. 8 г: 32 г/моль = 0,25 моль. Визначимо кількість речовини, що шукається в задачі. Якщо з 2 моль перекису водню виходить 1 моль кисню, то з х моль перекису водню вийде 0,25 моль кисню.
х = 2 · 0,25: 1 = 0,5. Кількість речовини перекису водню дорівнює 0,5 моль. Знайдемо масу перекису водню. Маса перекису водню дорівнює добутку його кількості речовини на молярну масу. 0,5 моль · 34 г/моль = 17 г. Відповідь: маса перекису водню дорівнює 17 г.
Таким чином, поняття молячи у поєднанні з хімічною реакцією є дуже зручним інструментом для розрахунків. Завдяки цьому поєднанню можна розрахувати необхідні кількості реагентів і продуктів у хімічних реакціях.
Чому б ти не вчився, ти
вчишся для себе.
Петроній
Цілі уроку:
- познайомити учнів з основними способами розв'язання задач з хімічних рівнянь:
- знаходити кількість, масу та обсяг продуктів реакції за кількістю, масою або обсягом вихідних речовин,
- продовжити формування навичок роботи з текстом завдання, вміння аргументовано вибирати спосіб розв'язання навчальної задачі, вміння складати рівняння хімічних реакцій.
- розвивати вміння аналізувати, порівнювати, виділяти головне, складати план дії, робити висновки.
- виховувати терпимість до інших, самостійність у прийнятті рішень, вміння об'єктивно оцінити результати своєї праці.
Форми роботи: фронтальна, індивідуальна, парна, групова.
Тип уроку: комбінований із застосуванням ІКТ
I Організаційний момент.
Здрастуйте хлопці. Сьогодні ми з вами навчимося вирішувати завдання щодо рівнянь хімічних реакцій. Слайд 1 (див. презентацію).
Цілі уроку Слайд 2.
II.Актуалізація знань, умінь, навичок.
Хімія дуже цікава та водночас складна наука. Для того, щоб знати і розуміти хімію, треба не тільки засвоювати матеріал, а й вміти застосовувати отримані знання. Ви дізналися, які ознаки вказують на перебіг хімічних реакцій, навчилися складати рівняння хімічних реакцій. Я сподіваюся, що ви добре засвоїли ці теми і легко відповісте на мої запитання
Яке явище не є ознакою хімічних перетворень:
а) поява осаду; в) зміна обсягу;
б) виділення газу; г) поява запаху. Слайд 3
Вкажіть цифрами:
а) рівняння реакцій сполуки
б) рівняння реакцій заміщення
в) рівняння реакцій розкладання Слайд 4
А, щоб навчитися вирішувати завдання, потрібно скласти алгоритм дій, тобто. визначити послідовність дій.
Алгоритм для розрахунку за хімічними рівняннями (у кожного учня на столі)
5. Записати відповідь.
Приступаємо до вирішення завдань, застосовуючи алгоритм
Обчислення маси речовини за відомою масою іншої речовини, що бере участь у реакції
Обчисліть масу кисню, що виділився в результаті розкладання
порції води масою 9 р.
Знайдемо молярну масу води та кисню:
М(Н 2 О) = 18 г/моль
М(О 2) = 32 г/моль Слайд 6
Запишемо рівняння хімічної реакції:
2Н 2 О = 2Н 2 + О 2
Над формулою в рівнянні реакції запишемо знайдене
значення кількості речовини, а під формулами речовин -
стехіометричні співвідношення, що відображаються
хімічним рівнянням
0,5моль х моль
2Н 2 О = 2Н 2 + О 2
2моль 1моль
Обчислимо кількість речовини, масу якої потрібно знайти.
Для цього складаємо пропорцію
0,5моль = хмоль
2моль 1моль
звідки х = 0,25 моль Слайд 7
Отже, n(O 2)=0,25 моль
Знайдемо масу речовини, яку потрібно обчислити
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 моль 32 г/моль = 8 г
Запишемо відповідь
Відповідь: m(Про 2) = 8 г Слайд 8
Обчислення обсягу речовини за відомою масою іншої речовини, що бере участь у реакції
Обчисліть об'єм кисню (н. у.), що виділився в результаті розкладання порції води масою 9 г.

V(0 2)=?л(н.у.)
М(Н 2 Про)=18 г/моль
Vm=22,4л/моль Слайд 9
Запишемо рівняння реакції. Розставимо коефіцієнти
2Н 2 О = 2Н 2 + О 2
Над формулою у рівнянні реакції запишемо знайдене значення кількості речовини, а під формулами речовин – стехіометричні співвідношення, що відображаються хімічним рівнянням
0,5моль - х моль
2Н 2 О = 2Н 2 + О 2 Слайд10
2моль - 1моль
Обчислимо кількість речовини, масу якої потрібно знайти. Для цього складемо пропорцію
![]()
звідки х = 0,25 моль
Знайдемо об'єм речовини, яку потрібно обчислити
V(0 2)=n(0 2) Vm
V(O 2)=0,25моль 22,4л/моль=5,6л (н. у.)
Відповідь: 5,6 л Слайд 11
III.Закріплення вивченого матеріалу.
Завдання для самостійного вирішення:
1.При відновленні вугіллям оксидів Fe 2 O 3 і SnO 2 отримали по 20 г Fe та Sn. Скільки грамів кожного оксиду було взято?
2.В якому разі утворюється більше води:
а) при відновленні воднем 10 г оксиду міді (I) (Cu 2 O) або
б) при відновленні воднем 10 г оксиду міді(II) (CuO)? Слайд 12
Перевіримо розв'язання задачі 1

M(Fe 2 O 3)=160г/моль
M(Fe)=56г/моль, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6г
Відповідь: 28,6г
Слайд 13
Перевіримо розв'язання задачі 2

M(CuO) = 80 г/моль
4. ![]()
х моль = 0,07моль,
n(H 2 O)=0,07 моль
m(H 2 O) = 0,07моль*18г/моль=1,26г
Слайд 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/M(CuO)
n(CuO) = 10г/80г/моль = 0,125моль
0,125моль хмоль
CuO + H 2 = Cu + H 2 O
1моль 1моль
![]()
х моль = 0,125моль, n(H 2 O)=0,125моль
m (H 2 O) = n * M (H 2 O);
m(H 2 O) = 0,125моль*18г/моль=2,25г
Відповідь: 2,25г Слайд 15
Домашнє завдання: вивчити матеріал підручника с. 45-47, розв'язати задачу
Яку масу оксиду кальцію та який об'єм вуглекислого газу (н.у.)
можна отримати при розкладанні карбонату кальцію масою 250г?
CaCO 3 = CaO + CO Cлайд 16.
Література
1. Габрієлян О.С. Програма курсу хімії для 8-11 класів загальноосвітніх закладів. М. Дрофа 2006р.
2. Габрієлян О.С. Хімія. 8 клас. Підручник для загальноосвітніх установ. Дрофа. М. 2005р.
3. Горбунцова С.В. Тести з основних розділів шкільного курсу хімії. 8 - 9 класи. Вако, Москва, 2006р.
4. Горковенко М. Ю. Поурочні розробки з хімії. До підручників О.С.Габрієляна, Л.С.Гузея, В.В.Сорокіна, Р.П.Суровцевої та Г.Е.Рудзітіса, Ф.Г.Фельдмана. 8 клас.ВАКО, Москва, 2004р.
5. Габрієлян О.С. Хімія. 8 клас: Контрольні та перевірочні роботи. - М.: Дрофа, 2003.
6. Радецький А.М., Горшкова В.П. Дидактичний матеріал з хімії для 8-9 класів: Посібник для вчителя. - М.: Просвітництво, 2000
Додаток.
Розрахунки з хімічних рівнянь
Алгоритм дій.
Для того, щоб розв'язати розрахункове завдання з хімії, можна скористатися наступним алгоритмом – зробити п'ять кроків:
1. Скласти рівняння хімічної реакції.
2. Над формулами речовин записати відомі та невідомі величини з відповідними одиницями виміру (тільки для чистих речовин, без домішок). Якщо за умовою завдання в реакцію вступають речовини, що містять домішки, спочатку необхідно визначити вміст чистої речовини.
3. Під формулами речовин з відомими та невідомими записати відповідні значення цих величин, знайдені за рівнянням реакцій.
4. Скласти та вирішити пропорцію.
5. Записати відповідь.
Співвідношення деяких фізико-хімічних величин та їх одиниць
Маса (m): г; кг; мг
Кількість в-ва (n): моль; кмоль; ммоль
Молярна маса (M): г/моль; кг/кмоль; мг/ммоль
Об'єм (V): л; м 3 /кмоль; мл
Молярний об'єм (Vm): л/моль; м 3 /кмоль; мл/ммоль
Число частинок (N): 6 1023 (число Авагадро - N A); 6 1026; 6 1020
Розрахунки за хімічними рівняннями (стехіометричні розрахунки) ґрунтуються на законі збереження маси речовин. У реальних хімічних процесах через неповне перебіг реакцій і втрат маса продуктів зазвичай менше теоретично розрахованої. Виходом реакції (ŋ) називають відношення реальної маси продукту (m практична) до теоретично можливої (m теоретична), виражене в частках одиниці або у відсотках:
ŋ = (m практична / m теоретична) 100%.
Якщо умовах завдань вихід продуктів реакції не зазначений, їх у розрахунках приймають за 100% (кількісний вихід).
Приклад 1. Скільки г міді утворюється за відновлення 8 г оксиду міді воднем, якщо вихід реакції становив 82% від теоретичного?
Рішення: 1. Розрахуємо теоретичний вихід міді за рівнянням реакції:
CuO + H2 = Cu + H2O
80 г (1 моль) CuO при відновленні може утворити 64 г (1 моль) Cu; 8 г CuO при відновленні може утворити Х г Cu
2. Визначимо, скільки грамів міді утворюється при 82% виході продукту:
6,4 г - 100% вихід (теоретичний)
Х г - 82%
X = (882) / 100 = 5,25 г
приклад 2.Визначте вихід реакції отримання вольфраму методом алюмінотермії, якщо з 33,14 г концентрату руди, що містить WO 3 і домішки, що не відновлюються (масова частка домішок 0,3) було отримано 12,72 г металу.
Рішення 1) Визначимо масу (г) WO 3 33,14 г концентрату руди:
ω(WO 3)= 1,0 - 0,3 = 0,7
m(WO 3) = ω(WO 3) m руди = 0,7 33,14 = 23,2 г
2) Визначимо теоретичний вихід вольфраму в результаті відновлення 23,2 г WO 3 порошком алюмінію:
WO3+2Al = Al2O3+W.
При відновленні 232 г (1 г-моль) WO 3 утворюється 187 г (1 г-моль) W, а з 23,2 г WO 3 –– Х г W
X = (23,2 187) / 232 = 18,7 г W
3) Розрахуємо практичний вихід вольфраму:
18,7 г W - 100%
12,72 г W - Y%
Y = (12,72 100)/18,7 = 68%.
Приклад 3. Скільки грамів осаду сульфату барію утворюється при зливанні розчинів, що містять 20,8 г хлориду барію та 8,0 г сульфату натрію?
Рішення. Рівняння реакції:
BaCl 2 + Na 2 SO 4 = BaSO 4 + 2NaCl.
Розрахунок кількості продукту реакції ведуть по вихідній речовині, взятій у нестачі.
1). Попередньо визначають, яке з двох вихідних речовин перебуває у нестачі.
Позначимо кількість г Na 2 SO 4 - X.
208 г (1моль) BaCl 2 реагує з 132 г (1 моль) Na 2 SO 4 ; 20,8 г - з Х г
X = (20,8132) / 208 = 13,2 г Na 2 SO 4 .
Ми встановили, що на реакцію з 20,8 г BaCl 2 витратиться 13,2 г Na 2 SO 4 а дано 18,0 г Таким чином, сульфат натрію взятий в реакцію в надлишку, і подальші обчислення слід вести по BaCl 2 взятому у нестачі.
2). Визначаємо кількість грамів осаду, що випав BaSO 4 . 208 г (1 моль) BaCl 2 утворює 233 г (1 моль) BaSO 4 ; 20,8 г - Y г
Y = (233 20,8) / 208 = 23,3 р.
Закон сталості складу
Вперше сформулював Ж. Пруст (1808).
Всі індивідуальні хімічні речовини молекулярної будови мають постійний якісний та кількісний склад та певну хімічну будову, незалежно від способу одержання.
З закону сталості складу випливає, що хімічні елементи поєднуються у певних кількісних співвідношеннях.
Наприклад, вуглець з киснем утворює сполуки з різним масовим співвідношенням елементів вуглецю та кисню. СО С: О = 3: 4 СО2 С: О = 3: 8 У жодних інших відносинах вуглець з киснем не з'єднуються. Це означає, що сполуки СО та СО2 мають постійний склад, який визначається ступенями окиснення валентності вуглецю у сполуках. Валентність кожного елемента має певні значення (їх може бути кілька, змінна валентність), тому склад сполук є певним.
Усе сказане вище відноситься до речовин молекулярної будови. Оскільки молекули мають певну хімічну формулу (склад), то речовина, що ними утворюється, має постійний склад (збігається, очевидно, зі складом кожної молекули). Винятком є полімери (що складаються з молекул різної довжини).
Складніша ситуація з речовинами немолекулярного будови. Йдеться про речовини в конденсованому (твердому та рідкому станах). Т.к. NaCl – іонна сполука у твердому стані (чергування Na+ та Cl–) у газоподібному – є окремими молекулами NaCl. У краплі рідини чи кристаліці не можна виділити окремі молекули. Наприклад FeO
Fe 2+ O 2 - Fe 2 + O 2 - і т.д. ідеальний кристал
Закон сталості складу вимагає, щоб число іонів Fe2+ дорівнювало числу іонів O2–. А ці числа навіть дуже маленьких кристаликів величезні (кубик, ребро 0,001 мм це – 5 × 1011). Для реального кристала це неможливо. У цьому кристалі неминучі порушення регулярності. Оксид заліза (II) може містити змінену кількість кисню, залежно від умов отримання. Реальний склад оксиду виражається формулою Fe1 - хO, де 0,16 х 0,04. Це бертолід, з'єднання змінного складу на відміну від дальтонідів з х = 0. При нестехіометричному складі іонної сполуки забезпечується електронейтральність. Замість відсутнього іона Fe 2+ присутні Fe 3+
В атомній (не іонній) речовині деякі атоми можуть бути відсутніми, а деякі замінювати один одного. Такі сполуки також відносять до дальтонідів. Формула інтерметалевого з'єднання міді з цинком, що є складовою частиною латуні, що існує в інтервалі складів 40 – 55 ат % Zn, можна записати так: (Cu0,.9 – 1,0Zn0,1 – 0)(Cu0 –,0,2Zn0 – 0 8) атоми міді можуть заміщатися атомами цинку і навпаки.
Закон сталості складу, таким чином, суворо виконується для речовин молекулярної будови (виключення високомолекулярні) і має обмежене застосування для немолекулярних речовин.
Масова частка елемента ω(Е)-це частка одного елемента у загальній масі речовини. Обчислюється у відсотках чи частках. Позначають грецькою літерою (омега). ω показує, яку частину становить маса даного елемента від усієї маси речовини:
ω(Е) = (n Ar(Е)) / Mr
де n – число атомів; Ar(Е) – відносна атомна маса елемента; Mr – відносна молекулярна маса речовини.
Знаючи кількісний елементний склад сполуки, можна встановити найпростішу молекулярну формулу. Для встановлення найпростішої молекулярної формули:
1) Позначають формулу сполуки A x B y C z
2) Розраховують відношення X: Y: Z через масові частки елементів:
ω (A) = (х Ar(А)) / Mr(A x B y C z)
ω (B) = (y Ar (B)) / Mr (A x B y C z)
ω (C) = (z Ar(C)) / Mr(A x B y C z)
X = (ω (A) Mr) / Ar (А)
Y = (ω (B) Mr) / Ar (B)
Z = (ω (C) Mr) / Ar (C)
x: y: z = (ω(A)/Ar(А)): (ω(B)/Ar(B)): (ω(C)/Ar(C))
3) Отримані цифри ділять на найменше отримання цілих чисел X, Y, Z.
4) Записують формулу сполуки.
Закон кратних відносин
(Д.Дальтон, 1803 р.)
Якщо два хімічні елементи дають кілька сполук, то вагові частки одного і того ж елемента в цих сполуках, що припадають на ту саму вагову частку другого елемента, відносяться між собою як невеликі цілі числа.
N 2 O N 2 O 3 NO 2 (N 2 O 4) N 2 O 5
Число атомів кисню в молекулах цих сполук, що припадають на два атоми азоту, відносяться між собою як 1:3:4:5.
Закон об'ємних відносин
(Гей-Люссак, 1808 р.)
"Обсяги газів, що вступають у хімічні реакції, та обсяги газів, що утворюються в результаті реакції, відносяться між собою як невеликі цілі числа".
Слідство. Стехіометричні коефіцієнти в рівняннях хімічних реакцій молекул газоподібних речовин показують, у яких об'ємних відносинах реагують чи виходять газоподібні речовини.
Приклади.
a) 2CO + O 2 = 2CO 2
При окисненні двох обсягів оксиду вуглецю (II) одним обсягом кисню утворюється 2 обсяги вуглекислого газу, тобто. об'єм вихідної реакційної суміші зменшується на 1 об'єм.
б) При синтезі аміаку з елементів:
N 2 + 3H 2 = 2NH 3
Один обсяг азоту реагує із трьома обсягами водню; утворюється при цьому 2 обсяги аміаку - обсяг вихідної газоподібної реакційної маси зменшиться у 2 рази.
«Міль дорівнює кількості речовини системи, що містить стільки ж структурних елементів, скільки міститься атомів у вуглеці – 12 (12 С) масою 0,012 кг (точно). При застосуванні моля структурні елементи мають бути специфіковані та можуть бути атомами, молекулами, іонами, електронами та іншими частинками або специфікованими групами частинок». Йдеться не про вуглецю взагалі, а його ізотоп 12 С, як і при введенні атомної одиниці маси. Так як в 12 г вуглецю 12 С міститься 6,02 × 10 23 атомів, то можна сказати, що моль - це кількість речовини, що містить 6,02 × 10 23 своїх структурних елементів (атомів або груп атомів, молекул, груп іонів (Na 2 SO 4), комплексні групи і т.д.). Число N A = 6,02 × 10 23 названо постійної Авогадро. Молярна маса речовини – це маса одного моля.Її звичайна одиниця виміру г/моль, позначення М.
Згадаймо, що відносна молекулярна маса (М r) – це відношення маси однієї молекули до маси атомної одиниці маси, що дорівнює 1/N A г.
Нехай відносна молекулярна маса якоїсь речовини дорівнює Мr. Обчислимо його молекулярну масу М.
Маса однієї молекули: m = М r а. = М r × г
Маса одного моль (NA молекул): М = m N A = М r × = М r . Бачимо, що чисельно молярна маса у грамах збігається із відносною молекулярною масою. Це наслідок вибору певної атомної одиниці маси (1/12 маси ізотопу вуглецю 12°С).
Розгорнутий план-конспект уроку «Розрахунки з хімічних рівнянь».
Підручник:О.С. Габрієлян.
Клас: 8
Тема урока:Розрахунки з хімічних рівнянь.
Тип уроку:комбінований.
Освітні завдання:ознайомити з розрахунками з хімічних рівнянь; сформувати в учнів знання про розрахунки з хімічних рівнянь; почати формувати вміння щодо складання хімічних рівнянь та розрахунків за рівняннями.
Виховні завдання:продовжити формування естественнонаучного світогляду, ставлення до одиничному і целом.
Розвиваючі завдання:продовжити формування вміння спостерігати, аналізувати, пояснювати, робити висновки.
Методи навчання:словесні (пояснення та розповідь вчителя), словесно - наочні (пояснення з використанням записів на класній дошці).
Обладнання:класна дошка, таблиця Д. І. Менделєєва.
Хід уроку:
1.Організаційний момент (2-5хв.)
Здрастуйте хлопці сідайте. Сьогодні на уроці ми з вами повинні навчитися проводити розрахунки з хімічних рівнянь.
2. Контроль знань та вмінь (10 – 15 хв.)
На попередніх заняттях ми з вами проходили рівняння хімічних реакцій, пригадаймо, що таке хімічне рівняння? (Хімічним рівнянням називають умовний запис хімічної реакції за допомогою хімічних формул та математичних знаків).
На основі якого закону пишуть хімічні реакції? (Закон збереження маси речовин).
Як він звучить? (Маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, що вийшли в результаті).
3. Пояснення нового матеріалу (20 – 30 хв.)
За хімічним рівнянням можна визначити, які речовини вступили в реакцію, і які утворилися, а також за хімічним рівнянням можна розрахувати масу, обсяг і кількість речовин, що реагують.
Для розрахунків дуже важливо вибрати відповідні один одному одиниці виміру маси, обсягу та кількості речовини. Давайте відкриємо підручники на сторінці 146 та знайдемо таблицю №7. Розглянемо з цієї таблиці співвідношення деяких одиниць фізико – хімічних величин.
Щоб вирішувати розрахункові завдання з хімії, можна скористатися алгоритмом. Алгоритм розв'язання задач дано у підручнику на сторінці 147.
Користуючись алгоритмом розв'язання задач, давайте вирішимо наступне завдання:
Завдання: Розрахуйте об'єм водню (н.у.), який буде потрібний для взаємодії з 230 кг оксиду заліза (ІІІ). Обчисліть кількість речовини води, яка утворюється.
Дано: Рішення:
m(Fe 2 O 3)=230кг 1. Запишемо рівняння хімічної реакції:
V(H 2) -?
n(H 2 O) -? 2. Запишемо відомі та невідомі числові значення над формулами речовин у рівнянні.
Оскільки маса дана в кілограмах, то обсяг знаходимо в кубічних метрах, а кількість речовини – у кіломолях. І тоді:
230кг х м 3 y кмоль
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
де х – обсяг водню V(H2), y – кількість речовини води n(H2O).
3. а)Знайдемо задану хімічним рівнянням масу 1кмоль Fe 2 O 3 і запишемо отримане значення під його формулою:
Мr(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
М(Fe 2 O 3) = 160 кг/кмоль.
б) Знайдемо заданий рівнянням об'єм 3 кмоль водню V = Vm*n, запишемо під формулою водню знайдене значення: V(3H 2) = 22,4 м 3 /кмоль * 3 кмоль = 67,2 м 3 .
в) Під формулою води вкажемо її кількість, задану рівнянням, - 3 кмоль.
Рівняння набуває вигляду
230кг х м 3 y кмоль
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160кг 67,2 м 3 3 кмоль
4. Складемо і вирішимо пропорції:
а) 230 = х, х = 230 * 67,2 = 201,6 (м 3) - обсяг водню V (H 2)
б) 230 = y, y = 230*3 = 9 (кмоль) – кількість речовини води n(H 2 O).
4. Первинне закріплення знань (10 – 12 хв.)
Розв'яжіть завдання (якщо можна, то кількома способами):
Завдання 1.У реакцію з киснем вступає 0,1 моль цинку. Яка кількість речовини кисню буде потрібна? Яка кількість речовини оксиду цинку утворюється?
Завдання 2.Цинк кількістю речовини 0,1 моль взаємодіє з киснем. Визначте масу кисню, що вступає в реакцію, а також масу оксиду цинку, що утворюється.
Завдання 3.Алюміній масою 6,3 г входить у реакцію з киснем. Визначте маси кисню і оксиду заліза, що утворюється, якщо алюміній містить 20% домішок.
Завдання 4.Який обсяг водню (н.у.) виділиться при взаємодії 2,7 г 25%-ї соляної кислоти з необхідною за реакцією кількістю речовини алюмінію? Яка кількість речовини?
Завдання 5.Який обсяг вуглекислого газу виділиться при згорянні 60 кг вугілля?
Завдання 6.Скільки молей оксиду кальцію утворюється при спалюванні в кисні 8 г кальцію, що містить 30% домішок?
5. Підсумок уроку (1-3 хв.)
Сьогодні на уроці ми з вами ще раз згадали написання хімічних рівнянь та навчилися проводити розрахунки за допомогою хімічних рівнянь.
6. Домашнє завдання (1 – 4 хв.)
§28, завдання у робочих зошитах.
Яка маса оксиду заліза (ІІІ) утворюється при спалюванні на повітрі 0,6 моль заліза?
Розрахуйте масу сульфіду алюмінію, що утворюється при сплавленні із сіркою 5,4 г алюмінієвої пудри. Скільки грамів сульфіду заліза (ІІ) утворюється при сплавленні із сіркою 11,2 г порошку заліза?
Визначте масу магнію, необхідного для одержання 19 г хлориду магнію (наприклад, спалюючи магній у хлорі).
Скільки літрів хлороводню утворюється при взаємодії хлору з 5,5 л водню?
Який обсяг водню може вступити у реакцію із 150 л кисню?
Який об'єм вуглекислого газу утворюється при спалюванні 8 л метану СН4?
Який об'єм вуглекислого газу утворюється під час спалювання 480 г вугілля?
Який обсяг кисню виділиться під час розкладання електричним струмом 100г води?
Який об'єм азоту утворюється під час вибуху 1 г йодистого азоту:
2NJ 3 = N 2 + 3J 2
Скільки грамів оксиду сірки (IV) утворюється при спалюванні 12,8 сірки?
Яка маса оксиду магнію утворилася при спалюванні в кисні 6 г магнієвої стружки?
Скільки грамів води утворюється при спалюванні у кисні 9 г водню?
Скільки грамів алюмінію треба взяти для одержання 30,6 г оксиду алюмінію?
Скільки грамів літію необхідно спалити в кисні для одержання 15 г оксиду літію?
Скільки грамів хлориду натрію утворюється при спалюванні у хлорі 11,5 г натрію?
Скільки молей заліза необхідно взяти для одержання 32,5 г хлориду заліза (ІІІ)?
Скільки грамів алюмінію необхідно взяти для одержання 80,1 г хлориду алюмінію?
Скільки молей оксиду кальцію утворюється при спалюванні у кисні 8 г кальцію?
Скільки грамів хлориду алюмінію утворюється при згорянні у хлорі 10,8 г алюмінієвої фольги?