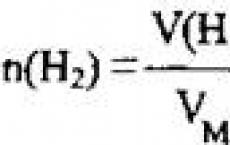Draženje, povezano s prekoračitvijo kemičnih reakcij. Uničenje kemijskih reakcij Uničenje kemijskih reakcij danih
ROZDIL I. ZAGALNA KEMIJA
4. Kemijska reakcija
Uporabite bolj tipična navodila
ІІ.Motnje v ozadju kemičnih reakcij
Zavdannya 7. Kakšna je uporaba vode (n.u.), ki jo porabimo za dopolnitev 0,4 mol kromovega (III) oksida?
podano:
Odločitev
Zapišimo reakcijo:
1. Iz zapisanega je razvidno, da
2. Če želite najti prostornino vode, uporabite formulo
Izvedba: V (H 2) = 26,88 l.
Vprašanje 8. Kakšna masa aluminija je reagirala s kloridno kislino, ki je bila 2688 ml (n.s.) vode?
podano:
![]()
Odločitev
Zapišimo reakcijo:

Naslednje razmerje: 54 g aluminija je 67,2 litra vode, x gram aluminija pa 2,688 litra vode:

Primer: m (A l) = 2,16 rub.
Zavdannya 9. Kakšno oksidacijo je treba dehidrirati, da sežge 120 m 3 dušika in ogljikovega (II) oksida, tako da bo prostornina dela dušika postala 40%?
podano:

Odločitev
1. Na koncu dneva bo zgorel samo ogljikov(II) oksid, katerega prostornina je:
2. Za formulo ![]() Izračunaj prostornino ogljikovega(II) oksida v vsoti:
Izračunaj prostornino ogljikovega(II) oksida v vsoti:
3. Zapišimo enako reakcijo, vikoristov zakon volumetričnih usedlin, in izvedimo razčlenitev:

Primer: V(O 2 ) = 3 6 m 3 .
Naloga 10. Izračunajte prostornino mešanice plinov, ki nastane pri termični razgradnji 75,2 g bakrovega (II) nitrata.
podano:
![]()
Odločitev
Zapišimo reakcijo:

1. Raztopimo veliko bakrovega(II) nitrata. M (Cu (NO 3 ) 2) = 188 g/mol:
2. Izvajamo določanje števila plinov, ki jih določajo naslednje reakcije:
3. Vsota plina je merljiva. V M = 22,4 l/mol:
Različica: V (sumishi) = 22,4 l.
Zavdannya 11. Kolikšna je prostornina žvepla (I) V ) lahko oksid ekstrahiramo iz 2,425 ton cinkove mešanice, pri čemer je masni delež cinkovega sulfida 80%?
podano:

Odločitev
1. Rozrahuemo masu ZnS v cinkovi prevari:

2. Reakcija je konsistentna, presega svoj izračunljivi volumen SO2. M (ZnS) = 97 g/mol, V M = 22,4 l/mol:

Izvedba: V (SO 2) = 448 m 3.
Naloga 12. Izračunajte prostornino kisline, ki jo je mogoče ekstrahirati s popolnim toplotnim raztezanjem 34 g dihidrogen peroksida z masnim deležem H 2 O 2 30 %.
podano:

Odločitev
1. Maso dihidrogen peroksida raztopimo na različne načine. M(H 2 O 2 ) = 34 g/mol:

2. Na njih bomo dosledno reagirali in izvajali preiskave. V M = 22,4 l/mol:

Primer: V(O 2 ) = 3,36 l.
Problem 13. Kakšno maso tehničnega aluminija z masnim deležem 3% je treba destilirati, da dobimo 2,5 mola sline iz sline?
podano:

Odločitev
1. Zapišimo reakcijo in raztopimo maso čistega aluminija, ki je potrebna za nadzor reakcije:

2. Aluminijaste drobce pomešamo s 3% hiše, nato
3. Formula  Rešujemo maso tehničnega aluminija (tudi hiše):
Rešujemo maso tehničnega aluminija (tudi hiše):
![]()
Izvedba: m (A l) Tech. = 61,9 rub.
Naloga 14. Po segrevanju 107,2 g mešanice kalijevega sulfata in kalijevega nitrata smo dobili 0,1 mol plina. Izračunajte mešanico kalijevega sulfata in izhodno mešanico soli.
podano:

Odločitev
1. Kalijev sulfat je termično stabilen. Tudi pri segrevanju se presežek kalijevega nitrata razgradi. Zapišimo reakcijo, postavimo delež, pomembno je, koliko kalijevega nitrata je izraženo:

2. Izračunajmo maso 0,2 mol kalijevega nitrata. M (KNO 3 ) = 101 g/mol:
3. Izračunajmo maso kalijevega sulfata v količini ob koncu tedna:
Primer: m(K 2 SO 4) = 87 rub.
Zavdannya 15. S popolnim toplotnim raztezanjem 0,8 mol aluminijevega nitrata smo dobili 35,7 g trdnega ostanka. Izračunajte izkoristek govora (%), ki se nahaja v trdnem presežku.
podano:

Odločitev
1. Zapišimo reakcijo razgradnje aluminijevega nitrata. Ko seštejemo delež, je pomembna količina govora n (A l 2 O 3):

2. Maso oksida raztopimo, ko se ta umiri. M(A l 2 O 3 ) = 102 g/mol:

3. Razširljiv izhod A l 2 O 3 z uporabo formule:
Zadeva: η (A l 2 O 3) = 87,5 %.
Soba 16. Pred razpakiranjem smo segreli 0,4 mol ferum(III) hidroksida. Oksid odstranimo z vodo in odstranimo 19,04 g tekočine. Izračunajte končni izkoristek (%).
podano:

Odločitev
1. Zapišimo reakcije:

2. Za rozinami se oblikuje stehiometrična shema, za proporci pa je pomemben teoretični izkoristek plezanja. n(Fe)t napad. :

3. Izračunano je, da bi lahko maso produkta teoretično dobili na podlagi izvedenih reakcij(M (Fe) = 56 g/mol):
4. Odpremo končni izhod odtoka:

Izvedba: η (Fe) = 85 %.
Vrstni red 17. Ko smo iz vode odstranili 234 g kalija, smo odstranili 56 litrov plina (n.s.). Izračunajte količino plina (%).
podano:

Odločitev
1. Zapišimo enako reakcijo in izračunano popijmo vodo, kar je teoretično tako. Odvisno od reakcije lahko kalij odstranimo iz te mase:

Seštejmo delež:

2. Izračunajmo končno količino vode:

Različica: η (H 2) = 83,3 %.
Problem 18. Ko smo iz acetilena odstranili 0,0168 m 3, smo odstranili 55 g ogljika(I). V ) oksid. Izračunajte trenutni izkoristek ogljikovega dioksida (%).
podano:

Odločitev
1. Zapišimo reakcijo acetilena, seštejmo delež in izračunajmo maso ogljika (I) V ) oksid, yaku lahko teoretično vsebuje. V M = 22,4 l/mol, M(CO 2) = 44 g/mol:

2. Izračunska proizvodnja ogljika (I) V) oksid:

Primer: η(CO 2 ) = 83,3 %.
Naloga 19. Pri katalitični oksidaciji 5,8 mol amoniaka je bilo odstranjenih 0,112 m 3 dušikovega(II) oksida. Izračunajte končni izkoristek vsebovanega oksida (%).
podano:

Odločitev
1. Zapišimo reakcijo katalitične oksidacije amoniaka, seštejmo delež in izračunajmo prostornino dušika(I) V ) oksid, ki ga je teoretično mogoče izolirati ( V M = 22,4 l/mol):

2. Tekoči izpust dušikovega (II) oksida se raztopi:

Različica: η(NO) = 86,2 %.
Zavdannya 20. Po razredčenju kalijevega hidroksida je skozi njo prešlo 1,2 mol dušika(I). V ) oksid. Vzeli smo 0,55 mol kalijevega nitrata. Izračunajte trenutni izkoristek zadržane soli (%).
podano:

Odločitev
1. Zapišimo kemijsko reakcijo, seštejmo delež in izračunajmo maso kalijevega nitrata, ki jo teoretično lahko izračunamo:

2. Izračunajte izkoristek kalijevega nitrata:
Različica: η (KNO 3) = 91,7 %.
Zavdannya 2 1 . Yakusa amonijev sulfat lahko pripravite s 56 litri amonijevega sulfata, če tekoči izkoristek soli postane 90%.
podano:

Odločitev
1. Zapišimo natančno reakcijo in delež ter izračunsko maso soli, ki jo teoretično lahko pridobimo v 56 litrih. NH3. V M = 22,4 l/mol M((NH 4) 2 S Pro 4 ) = 132 g/mol:

2. Izračunamo lahko količino soli, ki jo lahko praktično odvzamemo:
Primer: m ((NH 4 ) 2 S O 4 ) = 148,5 g.
Zavdannya 22. 1,4 mola soli smo popolnoma oksidirali s klorom. Koliko soli je bilo pridobljenega, kako lahko njen pridelek postane 95%?
podano:

Odločitev
1. Posnemimo reakcijo in izvedemo raztapljanje mešanice soli, ki ga lahko teoretično določimo. M (FeCl 3 ) = 162,5 g/mol:

2. Rozrahuemo masu FeCl3, Yakuja so praktično odpeljali:
Primer: m (FeCl 3) ex. ≈ 216 rub.
Zavdannya 23. Raztopini, ki je vsebovala 0,15 mol kalijevega ortofosfata, smo dodali raztopino, ki je vsebovala 0,6 mol argentum(I) nitrata. Razmislite o obleganju, zdaj ko je konec.
podano:

Odločitev
1. Zapišimo enako reakcijo ( M (Ag 3 P O 4) = 419 g/mol):

Vidimo, da je za reakcijo od 0,15 mol do 3 PO 4 potrebno 0,45 mol (0,15 3 = 0,45) argentum (I) nitrata. Fragmenti, iz uma, veliko govora AgN U 3 da postane 0,6 mola, se sam presežek odstrani, tako da njegov del ni prikrajšan za vikoristan. Kalijev ortofosfat vstopi neposredno v reakcijo, zato je proizvodnja izdelkov odvisna od stroškov.
2. Seštejte delež:

Primer: m (Ag 3 P O 4 ). = 62,85 rub.
Zavdannya 24. V vaseh, ki so vsebovale 58,4 g klorove vode, so postavili 16,2 g aluminija. Kakšen plin (št.) ste videli?
podano:

Odločitev
1. Izračunajmo količino aluminija in klora v vodi. M(A l) = 27 g/mol, M(HC l) = 36,5 g/mol:

2. Zapišimo reakcijo in vstavimo govor, povzet iz odvečnega:

Količina aluminija, ki jo lahko raztopi ta količina klorovodikove kisline, se lahko raztopi:

Tudi aluminij se vzame iz presežka: količina te snovi (0,6 mol) je večja od potrebne. Volumen vode je reguliran na volumen klorirane vode.
3. Popil sem veliko vode, ki sem jo videl. V M = 22,4 l/mol:

Izvedba: V (H 2) = 17,92 l.
Problem 25. Sumish, ki je zmešal 0,4 litra acetilena in 1200 ml kislega, je spomnil na reakcijo. Kakšna glasnost ogljik (І V ) se je oksid usedel?
podano:

Odločitev
Zapišimo reakcijo:

V skladu z zakonom volumetričnih razmerij iz inducirane poravnave sledi, da se na koži porabi 5 obveznosti. O2 z odobritvami 4 obveznosti ogljik (І V ) oksid. In prva stvar, ki šteje, je govor, saj ga je preveč - lahko ga preverimo in kislo zmeljemo v acetilen:
Fragmenti za ponori so napolnjeni z acetilenom, vzamemo 1,2 litra in potrebujemo 1 liter, previdno, tako da kislost vzamemo iz presežka in količino ogljika (I V ) se oksid razdeli na acetilen, ki pospešuje po zakonu volumetričnih razmerij plinov:
Primer: V(CO 2 ) = 0,8 l.
Problem 26. Kako zmešati 80 ml čiste vode in 120 ml O2 , opozoril na reakcijo in odstranil 70 ml žvepla (I V ) oksid. Zatiranje obveznosti plinov je bilo izvedeno zaradi novih umov. Izračunajte trenutni izkoristek žvepla(IV) oksid (%).
podano:

Odločitev
1. Zapišimo reakcijo gore na vročo vodo:

2. Preverimo, kako zmleti kislo vodo v 80 ml čiste vode:
No, kislo zmeljemo, ker so ji vzeli 120 ml od stehiometrične količine. Preveč sam h Ni govorov. In tega je preklinjal SO 2 Izkoristite lahko katerega koli od njih:
3. Izračunski izkoristek žvepla (I) V) oksid:
Različica: η (SO 2) = 87,5 %.
Zavdannya 27. Ko smo v vodi raztopili 0,28 g vode, smo dobili 0,448 litra vode (n.s.). Poimenuj kovinoin vnesite protonsko število.
podano:

Odločitev
1. Zapišimo reakcijo(V M = 22,4 l/mol):

Sestavimo delež in povečamo količino kovine:

2. Izračunamo lahko molsko maso kovine, ki vstopi v reakcijo:
![]()
To je litij. Protonsko število za litij je 3.
Različica: Z(Me) = 3.
Zavdannya 28. Kot rezultat popolne termične razgradnje 42,8 g hidroksida trivalentnega kovinskega elementa smo dobili 32 g trdnega ostanka. Navedite molsko maso kovinskega elementa.
podano:

Odločitev
1. Zapišimo reakcijo nevednega gledalca:
Edino, kar je mogoče razumeti, je, da je reakcija voda, uničenje pa se izvede po masi vode, ki se usede. Mayuchi zakon varčevanja z množico govorov, pomeni yogo maso:
2. Po reakciji bomo izvedli raztapljanje molske mase v hidroksid kovinskega elementa. Molarnusmasa hidroksida Me(OH) 3 signifikantno x g/mol (M(H 2) O) = 18 g/mol):

3. Molsko maso kovinskega elementa je mogoče izračunati:
Tse Ferum.
Različica: M(Me) = 56 g/mol.
Zavdannya 29. Bakrov (II) oksid smo oksidirali s 13,8 g nasičenega enohidroksilnega alkohola in ekstrahirali 9,9 g aldehida, končni dobitek je bil 75 %. Poimenujte alkohol in navedite njegovo molsko maso.
podano:

Odločitev
Najboljša možnost je, da napišete formulo enohidričnega alkohola, ki ga infundirate, da opišete reakcijo njegove oksidacije - to R - CH 2 OH, de R – alkilni intercessor, katerega halal formula n H 2 n +1 . Pomembno je omeniti, da je sama skupina CH 2 VINse med oksidacijsko reakcijo spremeni v aldehidno skupino-CHO.
1. Zapišimo reakcijo oksidacije alkohola v aldehid v temnem videzu:
2. Teoretično maso aldehida lahko izračunamo:

Za nadaljnji razvoj lahko uporabite 2 metodi.
І metoda (matematična metoda, ki prenaša številne aritmetične operacije).
Znatno molska masa alkilnega protektorja GOSPOD) skozi x g/mol. Todi:
![]()
Delež in izračunljivost molske mase alkilnega protektorja je:

Prav tako je alkilni zaščitnik metil-CH3 in alkohol je etanol CH3-CH2-VIN; M(Z2H5OH) = 46 g/mol.
II metoda.
Izračunajmo razliko v molskih masah ekoloških proizvodov na isto raven:
Jasno umu Δ m р = 13,8 – 13,2 = 0,6 (g).
Seštejmo delež: če vstopi v reakcijo 1 mol RCH2OH, potem je razlika v masi 2 g in v molu RCH2OH, potem je razlika v teži 0,6 g.

Za formulo  Raztopite molsko maso alkohola:
Raztopite molsko maso alkohola:

No, rezultat je enak.
Primer: M(Z 2 H 5 OH) = 46 g/mol.
Zavdannya 30 . Ko je bilo 87,5 g kristalnohidrata ferum(III) nitrata popolnoma napojenih, je bilo odstranjenih 1,5 mol vodne pare. Nastavite formulo za izhodni govor.
podano:

Odločitev
1. Izračunajmo maso 1,5 mol vode, ki je rezultat reakcije. M(H 2 O) = 18 g/mol:
2. Na podlagi zakona o ohranitvi mase izračunamo maso soli, ki smo jo odstranili iz segretega kristalnega hidrata:
3. Cenimo glasnost govora Fe(NO3)3. M (Fe (NO 3 ) 3 ) = 242 g/mol:
4. Izračunajte razmerje med količinama brezvodne soli in vode:

Za 0,25 mola soli je 1,5 mola vode na 1 mol soli:
Povzetek: formula za kristalni hidrat - Fe (NO 3) 3 6H2O.
Naloga 31. Izračunajte prostornino kisline, ki je potrebna za izhlapevanje 160 m3 ogljikovega(II) oksida, dušika in etana, tako da bodo prostornine komponent 50,0, 12,5 in 37,5 %.
podano:

Odločitev
1. Za formulo ![]() so količine vnetljivih komponent izračunljive inogljikov (II) oksid in etan (spoštljivo, ne kurite dušika):
so količine vnetljivih komponent izračunljive inogljikov (II) oksid in etan (spoštljivo, ne kurite dušika):
2. Zapišimo reakcijo gore CO in C 2 H 6:
![]()
3. S pospešitvijo zakona volumskega sproščanja plinov bomo izvedli razgradnjo kožnih kislinz enakimi reakcijami:

4. Izračunljivo sumarny obsya kisnyu:
Izvedba: V (Pro 2) = 250 m 3.
Rozhrahunki iz kemičnih regij
Ravnovesje kemičnih reakcij je lahko zelo praktično pomembno za motnje, povezane s to ali drugo reakcijo.
Spremembe nekaterih reaktantov v kemijskih reakcijah imenujemo stehiometrične.
Stehiometrija je veja kemije, ki vključuje izmenjavo mase in prostornine med reagenti.
Človek se vpraša, kako je mogoče določiti množico govorov, ki sodelujejo v reakciji. Ugibajmo, s čim so te vrednosti povezane med seboj:
Poleg tega imajo težave s kemijskimi znanostmi pogosto različne razsežnosti.
Oglejmo si kemijski problem: Izračunaj maso slinskega oksida (II), ki nastane pri oksidaciji s kislino 11,2 g sline.

Odločitev. Kemična reakcija je dosledna. Med procesom pranja kemikalija reagira s kislino Fe+O2 in oksidom (II) FeO. Ločimo koeficiente in odstranimo 2Fe+O2→2FeO. Na primer, količina tekočin, vključenih v to reakcijo, je izhodnih spojin in produktov, dodeljenih problemu, količina spojin, vključenih v reakcijo, je 2 mol, oksid (II) pa 2 mol. Vemo, koliko besed je za umom. Volumen sline je enak razmerju med maso sline in njeno molsko maso. 11,2 g: 56 g/mol = 0,2 mol. Pomembna je količina govora, ki se uporablja pri nalogi. Če 2 mola zalice dajeta 2 mola zalizumovega oksida (II), potem dobimo 0,2 mola zalizumovega x mol zalizumovega oksida (II). x = 0,2 2 : 2 = 0,2. Kislost sline (II) oksida je 0,2 mol. Poznamo maso oksida (II). Masa oksida (II) je enakovredna dodatku količine smole k oksidu (II) na molsko maso oksida (II). 0,2 mol 72 g/mol = 14,4 g Primer: masa oksida (II) je 14,4 g.
Na ta način se lahko algoritem za sprostitev takšne naloge izvede do naslednje:
1. zapišite svoje misli;
2. stopnje reakcije;
3. naročite število papirjev, iz katerih te reakcije sodelujejo v izhodnih besedah in izdelkih;
4. izmerite količino kožnega tkiva za umom;
5. podpisati pomen števila govorov pod enakimi reakcijami;
6. prešteti količino govora v nalogi;
7. najti veliko potrebnega govora;
8.posnemite svoje pričevanje.
Očitno še ena nesreča.
Koliko gramov peroksida je treba zdrobiti v vodo, da izločimo 8 g kislosti. Podano: masa kisnyu 8 r.

Odločitev. Kemična reakcija je dosledna. Vodni peroksid se razdeli v vodo in žele. H2O2 → H2O + O2. Določimo koeficiente. 2H2O2 → 2H2O + O2. Možno je, da v tej reakciji sodelujejo produkti, ki so dodeljeni problemu, količina vodikovega peroksida je vodna - 2 mol, kislina - 1 mol. Vemo, koliko besed je za umom. Kislost kislosti kisline je enaka njeni molski masi. 8 g: 32 g/mol = 0,25 mol. Pomembna je količina govora, ki se uporablja pri nalogi. Če za 2 mola vodnega peroksida dobite 1 mol kisle vode, potem za 3 x mole vodnega peroksida dobite 0,25 mola kisle vode.
x = 2 · 0,25: 1 = 0,5. Moč vodnega peroksida je 0,5 mol. Vemo, kako uporabljati vodni peroksid. Mešanica vodnega peroksida vsebuje enako količino vode na molsko maso. 0,5 mol · 34 g/mol = 17 g Primer: zmes vodnega peroksida 17 g.
Tako razumemo, da je mleko povezano s kemično reakcijo in je celo priročno orodje za otekanje. Vendar lahko ta povezava vključuje potrebne količine reagentov in produktov v kemičnih reakcijah.
Zakaj ne razumeš, zakaj?
pridobi si ga zase.
Petronij
Cilji lekcije:
- Študente seznani z osnovnimi načini reševanja problemov v kemijskih vedah:
- poznate količino, maso in količino reakcijskih produktov za količino, maso in količino izhodov,
- nadaljevanje oblikovanja robota z besedilom naloge, je smiselno izbrati način razvoja začetne naloge in oblikovati raven kemijskih reakcij.
- razvijati, analizirati, analizirati, videti glavo, sestaviti akcijski načrt, delati na idejah.
- razvijati strpnost do drugih, samostojnost pri odločanju in objektivno vrednotiti rezultate svojega dela.
Oblike dela: frontalna, individualna, par, skupinska.
Vrsta lekcije: kombinacije aplikacij IKT
I Organizacijski trenutek.
Zdravo družba. Danes se bomo naučili reševati probleme kemijskih reakcij. Diapozitiv 1 (izjemna predstavitev).
Cilji lekcije Diapozitiv 2.
II.Posodobitev znanja, spretnosti, spretnosti.
Kemija je zelo preprosta in znanost je hkrati kompleksna. Za poznavanje in razumevanje kemije je treba ne le obvladati snov, ampak znanje tudi utrditi. Ugotovili ste, kateri znaki kažejo na potek kemijskih reakcij, in začeli oblikovati niz kemijskih reakcij. Verjamem, da ste s temi opravili dobro in se zlahka odzovete na moje zahteve
Ta pojav ni znak kemičnih transformacij:
a) videz obleganja; c) sprememba dolžnosti;
b) vid plina; d) pojav vonja. Diapozitiv 3
Zapišite v številkah:
a) izenačenje polovičarskih reakcij
b) izenačenje substitucijskih reakcij
c) izenačenje reakcij postavitve Diapozitiv 4
In da bi se naučili ugotoviti resnico, morate sestaviti algoritem dejanj. določite zaporedje dejanj.
Algoritem za razvoj kemičnih obdelav (pri kožnem testu na mizi)
5. Posnemite svoje pričevanje.
Nadaljujemo z dokončanjem naloge, stagnacijo algoritma
Štetje mase govora po drugi množici govora, ki sodeluje v reakciji
Izračunajte kislost mase, ki je bila vidna kot rezultat postavitve
dele vode 9 r.
Poznamo molsko maso vode in kislost:
M(H2O) = 18 g/mol
M(O 2) = 32 g/mol Diapozitiv 6
Zapišimo kemijsko reakcijo:
2H 2 O = 2H 2 + O 2
Nad formulo v enaki reakciji napišemo najdeno
pomen števila govorov in pod formulami govorov -
stehiometrična razmerja, ki so prikazana
kemijske enake
0,5 mol x mol
2H 2 O = 2H 2 + O 2
2 mol 1 mol
Lahko preštejemo število govorov, katerih maso morate poznati.
Za koga oblikujemo delež
0,5 mol = hopmol
2 mol 1 mol
zvezdice x = 0,25 mol Diapozitiv 7
Otzhe, n(O 2) = 0,25 mol
Maso govorov poznamo, zato moramo računati
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Zapišimo priznanje
Različica: m(Pro 2) = 8 g Diapozitiv 8
Izračun dolžnosti govora po množici drugih govorov, ki sodelujejo v reakciji
Izračunajte prostornino kisline (št.), ki nastane, ko razdelite del vode, ki tehta 9 g.

V(0 2)=?l(n.s.)
M(H2Pro) = 18 g/mol
Vm=22,4l/mol Diapozitiv 9
Zapišimo reakcijo. Postavimo koeficiente
2H 2 O = 2H 2 + O 2
Nad formulo reakcije zapišemo vrednost količine reakcije, pod formulami reakcije pa stehiometrično razmerje, ki ga predstavlja kemijska reakcija.
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 Slide10
2 mol - 1 mol
Lahko preštejemo število govorov, katerih maso morate poznati. Za koga oblikujemo delež
![]()
zvezdice x = 0,25 mol
Poznamo glasnost govora, ki jo je treba izračunati
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (št.)
Tip: 5,6 l Diapozitiv 11
III Zavarovanje cepljenega materiala.
Navodila za samostojno krepostnost:
1. Pri obnavljanju oksidov Fe 2 O 3 in SnO 2 smo vzeli 20 g Fe in Sn. Koliko gramov kožnega oksida je bilo vzetih?
2. Kdaj se doda več vode:
a) s prenovljeno vodo 10 g bakrovega (I) oksida (Cu 2 O) oz.
b) z obnovljeno vodo 10 g bakrovega(II) oksida (CuO)? Diapozitiv 12
Preverimo povezavo naloge 1

M(Fe 2 O 3) = 160 g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Vrsta: 28,6g
Diapozitiv 13
Preverimo rešitev 2. naloge

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H2O)=0,07 mol
m(H 2 O) = 0,07 mol*18 g/mol = 1,26 g
Diapozitiv 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/M(CuO)
n(CuO) = 10g/80g/mol = 0,125mol
0,125 mol hmelja
CuO + H 2 = Cu + H 2 O
1 mol 1 mol
![]()
x mol = 0,125 mol, n(H 2 O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H 2 O) = 0,125mol*18g/mol=2,25g
Vrsta: 2,25g Diapozitiv 15
Domača naloga: preberite gradivo pri mojstru. 45-47, reši nalogo
Yaku masa kalcijevega oksida in prostornina ogljikovega dioksida (n.o.)
Ali lahko vzamete 250 g kalcijevega karbonata, ko ga položite?
CaCO3 = CaO + CO Diapozitiv 16.
Literatura
1. Gabrielyan O.S. Program tečaja kemije za 8.-11. M. Bustard 2006 r.
2. Gabrielyan O.S. kemija. 8. razred Priročno orodje za namestitev osvetlitve ozadja. Droplja. M. 2005r.
3. Gorbuntsova S.V. Preizkusi iz glavnih delov šolskega tečaja kemije. 8-9 razred. Vako, Moskva, 2006.
4. Gorkovenko M. Yu. Lekcije iz kemije. Asistentom O. S. Gabrielyanu, L. S. Guzeyu, V. V. Sorokinu, R. P. Surovcevi in G. E. Rudzitisu, F. G. Feldmanu. 8. razred VAKO, Moskva, 2004.
5. Gabrielyan O.S. kemija. 8. razred: Krmilni in obračalni roboti. - M .: Bustard, 2003.
6. Radetskiy A.M., Gorškova V.P. Didaktično gradivo s kemijo za 8.-9. razred: Priročnik za učitelja. - M.: Prosvitnitstvo, 2000
Dodatek.
Rozhrahunki iz kemičnih regij
Algoritem dejanj.
Če želite odkleniti oddelek za kemijo, lahko hitro uporabite naslednji algoritem - zaslužite pet kreditov:
1. Stopnje kemijske reakcije.
2. Nad formulami govorov napiši znane in neznane količine s posebnimi enotami sveta (samo za čiste govore, brez hiš). Ker govori pridejo v reakcijo za umom, da pometejo hiše, je takoj treba uporabiti namesto čistega govora.
3. Pod formulami znanih in neznanih besed zapišite ustrezne vrednosti teh količin, ki jih najdemo v reakcijah.
4. Poravnajte in uravnotežite delež.
5. Posnemite svoje pričevanje.
Razmerja med različnimi fizikalnimi in kemijskimi količinami ter njihovimi enotami
Masa (m): g; kg; mg
Količina snovi (n): mol; kmol; mmol
Molska masa (M): g/mol; kg/kmol; mg/mmol
Prostornina (V): l; m 3 /kmol; ml
Molski volumen (Vm): l/mol; m 3 /kmol; ml/mmol
Število delcev (N): 6 1023 (Avagadrovo število - N A); 6 1026; 6 1020
Ločljivosti na podlagi kemijskih zmesi (stehiometrične porazdelitve) temeljijo na zakonu o ohranitvi mase snovi. Pri realnih kemijskih procesih je zaradi neenakomernega poteka reakcije in porabe mase produktov manj teoretičnega zavarovanja. Rezultat reakcije (ŋ) imenujemo razmerje med dejansko maso izdelka (m praktično) in teoretično možno (m teoretično), izraženo v delih ena ali v stotinah:
ŋ = (m praktično / m teoretično) 100 %.
Če določite izkoristek reakcijskih produktov, se upoštevajo kot 100 % (nizek izkoristek).
Zadnjica 1. Koliko gramov medu se pretvori v 8 gramov bakrovega oksida v vodi, tako da reakcijski izkoristek postane 82 % teoretične vrednosti?
Rešitev: 1. Teoretični izhod medija se razreši z enakimi reakcijami:
CuO + H2 = Cu + H2O
80 g (1 mol) CuO lahko ob obnovi raztopi 64 g (1 mol) Cu; 8 g CuO z obnovo lahko proizvede X g Cu
2. Pomembno je, koliko gramov medu se stabilizira pri 82% izkoristku v izdelku:
6,4 g - 100% izkoristek (teoretično)
X g - 82 %
X = (882) / 100 = 5,25 g
rit 2. Kot rezultat reakcije ekstrakcije volframa z aluminotermično metodo je bilo iz 33,14 g koncentrata rude ekstrahirano 12,72 g kovine, ki vsebuje WO 3 in hišice, ki se ne obnavljajo (masni delež hišic je 0,3).
Odločitev 1) Bistvena masa (g) WO 3 33,14 g koncentrata rude:
ω(WO 3)= 1,0 - 0,3 = 0,7
m(WO 3) = ω(WO 3) m ruda = 0,7 33,14 = 23,2 g
2) Pomemben teoretični izkoristek volframa kot rezultat posodobitve 23,2 g WO 3 z aluminijevim prahom:
WO3+2Al = Al2O3+W.
Z dodatkom 232 g (1 g-mol) WO 3 se stabilizira 187 g (1 g-mol) W, s 23,2 g WO 3 pa – X g W.
X = (23,2 187) / 232 = 18,7 g W
3) Najbolj praktična rešitev za volfram je:
18,7 g W - 100 %
12,72 g W - Y%
Y = (12,72 100)/18,7 = 68 %.
Zadnjica 3. Koliko gramov oborine barijevega sulfata nastane med prelivanjem vode, da nadomestimo 20,8 g barijevega klorida in 8,0 g natrijevega sulfata?
Odločitev. Reakcija tekmeca:
BaCl 2 + Na 2 SO 4 = BaSO 4 + 2NaCl.
Koncentracija reakcijskega produkta se izvede z uporabo izhodne raztopine, vzete iz vira.
1). Prvič, jasno je, da iz dveh izhodnih govorov obstaja pomanjkanje.
Kalorična vrednost g Na 2 SO 4 - X je pomembna.
208 g (1 mol) BaCl 2 reagira s 132 g (1 mol) Na 2 SO 4; 20,8 g - v x g
X = (20,8132) / 208 = 13,2 g Na 2 SO 4.
Ugotovili smo, da za reakcijo z 20,8 g BaCl 2 porabimo 13,2 g Na 2 SO 4 in damo 18,0 g. Tako se v reakcijo vzame presežek natrijevega sulfata, nadaljnji izračuni pa se izvedejo glede na BaCl 2 vzeto iz ostanka.
2). To pomeni, da je veliko gramov usedline, ki je dodala BaSO 4 . 208 g (1 mol) BaCl 2 raztopi 233 g (1 mol) BaSO 4; 20,8 g - Y g
Y = (233 20,8) / 208 = 23,3 rub.
Zakon o stanju delnic
Prvič ga je oblikoval J. Proust (1808).
Vse posamezne kemične spojine molekularnega izvora imajo stalno kislo in kislo sestavo ter izrazito kemično sestavo ne glede na način pridobivanja.
Po zakonu o skladiščenju jekla sledi, da se kemični elementi porabijo v najbolj priljubljenih razmerjih.
Na primer, oglje s kislostjo se kombinira z različnimi masnimi elementi oglja in kislosti. CO C: O = 3: 4 CO2 C: O = 3: 8 V drugih vodah se ogljik ne spaja s kislo. To pomeni, da so delci CO in CO2 shranjeni v stabilnem stanju, kar kažejo stopnje oksidacije valence ogljika v polprevodnikih. Valenca kožnega elementa ima drugačen pomen (njihova valenca je lahko različna), zato je sestava rezultata drugačna.
Vse, kar je bilo povedano, bo bolj verjetno preneseno v govore molekularne resničnosti. Fragmenti molekule tvorijo kemijsko formulo (shranjevanje), nato snov, ki jo raztopijo, tvori trajno shrambo (očitno v kombinaciji s shrambo kožne molekule). Krivec so polimeri (ki so sestavljeni iz različnih molekul).
Kompleksna situacija z govori nemolekularne snovi. Govorite o govorih v zgoščenih (trdnih in redkih) razmerah. Ker NaCl je ionska spojina v trdnem stanju (tvorba Na+ in Cl–) v plinasti obliki – s trdnimi molekulami NaCl. V redkih kapljicah in kristalih ne morete videti molekul okoli njih. Na primer FeO
Fe 2+ O 2 - Fe 2 + O 2 - itd. popoln kristal
Velja zakon skladiščnih pogojev, da je število ionov Fe2+ enako številu ionov O2–. In te številke so odlične tudi za majhne kristale (kocka, rob 0,001 mm - 5 × 1011). Za pravi kristal je to nemogoče. Ta kristal ima neizogibno motnjo pravilnosti. Salizat (II) oksid lahko nadomesti kislost kisline, ki jo je treba odstraniti iz tekočine. Dejansko sestavo oksida izrazimo s formulo Fe1 - xO, de 0,16 x 0,04. To je bertolid, povezan s spremenljivo hranilno enoto v obliki daltonidov z x = 0. Z nestehiometričnim shranjevanjem ionske plasti je zagotovljena električna nevtralnost. Zamenjava dnevnega Fe 2+ iona z dnevnim Fe 3+
V atomskem (ne ionskem) govoru so lahko dejanja atomov ena in ista in dejanja se lahko zamenjajo. Takšne ideje lahko štejemo tudi za barvno slepe. Formulo intermetalne spojine bakra s cinkom, ki je skladiščni del medenine, ki se pojavlja v skladiščnem območju 40 – 55 at% Zn, lahko zapišemo takole: (Cu0,9 – 1,0Zn0,1 – 0 )(Cu0 –.0 ,2Zn0 – 0 8) atome bakra lahko nadomestimo z atomi cinka in glede na to,
Zakon stabilnosti skladišča je tako strogo definiran za molekularne snovi (razen za visokomolekularne) in je lahko enoten za nemolekularne snovi.
Masni delež elementa ω(E)- celoten del enega elementa v zagalni masi govora. Izračuna se na stotine in po delih. Označena z grško črko (omega). ω kaže, kolikšen del je masa tega elementa glede na celotno maso govora:
ω(E) = (n Ar(E)) / Mr
kjer je n število atomov; Ar(E)—obilna atomska masa elementa; Mr – visoka molekulska masa korenike.
Če poznate kemijsko elementarno shranjevanje spojine, lahko določite najpreprostejšo molekulsko formulo. Za določitev najpreprostejše molekulske formule:
1) Označite formulo A x B y C z
2) Razširite razmerja X: Y: Z skozi masne dele elementov:
ω (A) = (x Ar(A)) / Mr(A x B y C z)
ω (B) = (y Ar (B)) / Mr (A x B y C z)
ω (C) = (z Ar(C)) / Mr(A x B y C z)
X = (ω (A) Mr) / Ar (A)
Y = (ω(B)Mr)/Ar(B)
Z = (ω(C)Mr)/Ar(C)
x: y: z = (ω(A)/Ar(A)): (ω(B)/Ar(B)): (ω(C)/Ar(C))
3) Števke delite z najmanjšim številom celih števil X, Y, Z.
4) Zapišite formulo spoluka.
Zakon večkratnikov
(D. Dalton, rojen 1803)
Če dva kemična elementa dajeta enak rezultat, potem so deli enega in istega elementa v teh delih, ki spadajo na isti del drugega elementa, povezani med seboj kot majhna cela števila.
N 2 O N 2 O 3 NO 2 (N 2 O 4) N 2 O 5
Število dušikovih atomov v molekulah teh molekul, ki padejo na dva dušikova atoma, je med seboj porazdeljeno v razmerju 1: 3: 4: 5.
Zakon volumetričnih depozitov
(Gay-Lussac, rojen leta 1808)
"Količine plinov, ki vstopijo v kemične reakcije, in količine plinov, ki nastanejo kot posledica reakcije, so med seboj povezane kot majhne številke."
Preiskava. Stehiometrični koeficienti v kemijskih reakcijah molekul plinom podobnih snovi kažejo, v katerih volumetričnih vodah plinom podobne snovi reagirajo in izstopajo.
Nanesite ga.
a) 2CO + O 2 = 2CO 2
Ko dve tekočini oksidiramo v ogljikov dioksid (II) z eno tekočino, potem nastaneta dve tekočini ogljikovega dioksida. Volumen izhodne reakcijske zmesi se spremeni za 1 volumen.
b) Pri sintezi amoniaka iz elementov:
N2 + 3H2 = 2NH3
Ena kopel dušika reagira s tremi kopelmi vode; se usede, ko se doda 2 dodatka amoniaka - ko se izhodna plinu podobna reakcijska masa spremeni 2-krat.
»V sistemu je toliko besed, kot je toliko strukturnih elementov, kolikor je atomov v premogu – 12 (12 C) s težo 0,012 kg (natančno). Ko so zamrznjeni, so strukturni elementi lahko specifični in so lahko atomi, molekule, ioni, elektroni in drugi delci ali specifične skupine delcev.« Ne gre za ogljik, ki je zgorel, ampak za njegov izotop 12 C, kot pri uvedbi atomske enote za maso. Ker je v 12 g ogljika 12 C 6,02 × 10 23 atomov, potem lahko rečemo, da je mol veliko govora, ki vsebuje 6,02 × 10 23 svojih strukturnih elementov (atomov ali skupin atomov, molekul, skupin ioniv ( Na 2 SO 4), kompleksne skupine itd.). Število N A = 6,02 × 10 23 je poimenovano Avogadro. Molska masa rechovinija je masa enega mola. To je primarna enota vimir g/mol, označena z M.
Jasno je, da je molekulska masa (Mr) razmerje med maso ene molekule in maso atomske enote mase, ki je enako 1/N A g.
Imejmo jasno molekulsko maso, ki je starodavna beseda Mr. Izračunljivo z molekulsko maso M.
Masa ene molekule: m = M r a. = M r × g
Masa enega mola (molekul NA): M = m N A = M r × = M r. Bachimo, da je numerična molska masa v gramih izločena iz molekulske mase tekočine. To je posledica izbire ene same atomske enote mase (1/12 mase izotopa ogljika 12°C).
Zložen oris za lekcijo "Rozrahunki iz kemijskih regij."
Područnik: O.S. Gabrielyan.
Razred: 8
Tema lekcije: Rozrahunki iz kemičnih regij.
Vrsta lekcije: kombinacije.
Razsvetljava prostorov: se zavedajte kemičnih razpadov; oblikovati znanstvena spoznanja o kemičnih razpadih; Mešanico začnite previdno oblikovati, dokler se ne oblikujejo kemične plasti in plasti za plastmi.
Vikhovny Zavodnya: nadaljevati oblikovanje naravoslovnega pogleda, usmerjenega v posameznika in celoto.
Rastlina v razvoju:še naprej oblikovati, opazovati, analizirati, razlagati in delati na ideji.
Metode učenja: verbalno (razlaga in izpoved učitelja), verbalno - naochni (razlaga vikoristannyh zapiskov o učilnici).
Obladnannya: Učilnica, miza D. I. Mendelev.
Naslov lekcije:
1.Organizacijski trenutek (2-5. stopnja)
Pozdravljeni, sedite. Danes se boste pri pouku naučili izvajati kemično obdelavo.
2. Kontrola znanja in spomina (10 – 15 minut)
V naših prejšnjih lekcijah smo šli skozi vrsto kemijskih reakcij. Uganite, kakšna je ta kemijska reakcija? (Kemijski raziskovalci imenujejo mentalni zapis kemijske reakcije z uporabo kemijskih formul in matematičnih simbolov).
Na podlagi katerega zakona so zapisane kemijske reakcije? (Zakon o ohranitvi mase rehovinov).
Kako se sliši? (Množica govorov, ki so vstopili v kemično reakcijo, je starodavna množica govorov, ki so nastali kot rezultat).
3. Razlaga nove snovi (20 – 30 stoletja)
S kemijskimi meritvami lahko ugotovite, katere spojine so reagirale in katere so bile raztopljene, s pomočjo kemijskih meritev pa lahko izluščite maso, zmes in število spojin, ki reagirajo.
Za razvoj dogodkov je pomembno izbrati eno vrsto gradiva, eno za drugo, in več besed. Odprimo priročnike na strani 146 in poiščimo tabelo št.7. Oglejmo si to tabelo razmerij med različnimi enotami fizikalnih in kemijskih količin.
Za določitev razčlenitve težav s kemijo lahko hitro uporabite algoritem. Algoritem za reševanje nalog je podan pri pomočniku na strani 147.
Ko smo preučili algoritem za reševanje problemov, poglejmo v prihodnost:
Zavdannya: Raztopite prostornino vode (n.a.), potrebno za interakcijo z 230 kg slanega oksida (III). Izračunajte količino vode, potrebno za raztapljanje.
Podano: Resolucija:
m(Fe 2 O 3) = 230 kg 1. Zapišimo stopnjo kemijske reakcije:
V(H2) -?
n(H 2 O) -? 2. Zapišimo znane in neznane številčne vrednosti nad formulami govorov v državi.
Količina mase je podana v kilogramih, nato je količina mase podana v kubičnih metrih, količina govora pa je podana v kilomolih. In potem:
230 kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
de x – prostornina vode V(H2), y – prostornina vode n(H2O).
3. a) Vemo, da je masa 1 kmol Fe 2 O 3 podana kemijskim enačbam in vrednost zapišemo pod njeno formulo:
Mr(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
M(Fe 2 O 3) = 160 kg/kmol.
b) Poznamo naloge za nivo 3 kmol vode V = Vm*n, najdeno vrednost zapišemo pod formulo vode: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Po formuli vode je prostornina, dana ljudem, 3 kmol.
Rhinestone je na videz cvetoč
230 kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160 kg 67,2 m 3 3 kmol
4. Sestavljena in pravilna razmerja:
a) 230 = x, x = 230 * 67,2 = 201,6 (m 3) - pretočena voda V (H 2)
b) 230 = y, y = 230*3 = 9 (kmol) – prostornina vode n(H 2 O).
4. Primarno utrjeno znanje (10 – 12 stoletja)
Odklenite zapoved (če je mogoče, potem na več načinov):
Zavdannya 1. Reakcija s kislino vključuje 0,1 mol cinka. Koliko kislega govora bo potrebno? S koliko reagira cinkov oksid?
Zavdannya 2. Cink reagira s kislino s hitrostjo 0,1 mol. Ne pozabite dodati kislosti, ki vstopi v reakcijo, in dodajte tudi cinkov oksid, ki se strdi.
Zavdannya 3. Aluminij, ki tehta 6,3 g, vstopi v reakcijo s kislino. Dodajte kislost in slanost oksida za strjevanje tako, da mešanici dodate 20% aluminija.
Zavdannya 4. Kakšno vodo (n.n.) opazimo, ko 2,7 g 25% klorovodikove kisline reagira z zahtevano količino aluminijevega oksida? Koliko je govora?
Zavdannya 5. Kakšen ogljikov dioksid nastane pri zgorevanju 60 kg ogljikovega dioksida?
Zavdannya 6. Koliko molov kalcijevega oksida se raztopi, ko 8 g kalcija pljunemo v kislino, da vsebuje 30 % hiše?
5. Učna torba (1-3 koraki)
Danes ste se pri pouku ponovno naučili pisati kemijske enačbe in začeli izvajati razvoj s pomočjo kemijskih enačb.
6. Domače vrtnarjenje (1 – 4 hv.)
§28, delavnica pri delavskih zošitih.
Kolikšna masa oksida (III) v slini se stabilizira, ko 0,6 mol sline izpljunemo v zrak?
Mešanico poškropimo z aluminijevim sulfidom, ki se pri taljenju s 5,4 g aluminijevega prahu strdi. Koliko gramov nadomestnega sulfida (II) nastane, ko se 11,2 g nadomestnega prahu stopi s svetlim prahom?
Vzemite količino magnezija, ki je potrebna, da vsebuje 19 g magnezijevega klorida (na primer sežiganje magnezija v kloru).
Koliko litrov klorirane vode nastane, ko klor reagira s 5,5 litra vode?
Kakšna voda lahko reagira s 150 litri kisline?
Kolikšna prostornina ogljikovega dioksida nastane, ko izhlapi 8 litrov metana CH4?
Kolikšna prostornina ogljikovega dioksida nastane na uro razsutja 480 g premoga?
Kako vidite kislost ob uri točenja 100 g vode z električnim curkom?
Kolikšna količina dušika se raztopi v eni uri po pitju 1 g dušikovega jodida:
2NJ 3 = N 2 + 3J 2
Koliko gramov žveplovega (IV) oksida se raztopi, ko porabimo 12,8 žvepla?
Kakšna masa magnezijevega oksida je nastala, ko smo 6 g magnezijevih ostružkov pljunili v kislino?
Koliko gramov vode se raztopi, če kisli vodi dodamo 9 g vode?
Koliko gramov aluminija je potrebnih za tvorbo 30,6 g aluminijevega oksida?
Koliko gramov litija je treba sežgati v kislem, da dobimo 15 g litijevega oksida?
Koliko gramov natrijevega klorida se raztopi, ko 11,5 g natrija pomešamo s klorom?
Koliko molov soli je potrebnih, da dobimo 32,5 g solnega klorida (III)?
Koliko gramov aluminija potrebujemo, da dobimo 80,1 g aluminijevega klorida?
Koliko molov kalcijevega oksida nastane, ko kislini dodamo 8 g kalcija?
Koliko gramov aluminijevega klorida nastane pri segrevanju 10,8 g aluminijaste folije s klorom?